Thủ thuật
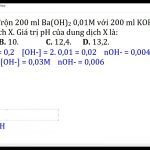
Tính nồng độ mol của các ion trong dung dịch KOH 0,02M

The concentration of ions in the solution can be calculated as follows:
a) KOH 0.02M: [K+] = [OH-] = 0.02 M
b) BaCl2 0.015M: [Ba2+] = 0.015 M, [Cl-] = 2 x 0.015 M = 0.03 M
c) HCl 0.05M: [H+] = [Cl-] = 0.05 M
d) (NH4)2SO4 0.01M: [NH4+] = 2 x 0.01 M = 0.02 M, [SO42-] = 0.01 M
In question 4, the volume of Ba(OH)2 solution with a concentration of 0.5M that contains the same number of moles of OH- ions as in a solution of NaOH with a concentration of 20% and a mass of 200g can be calculated by using the equation nOH- (Ba(OH)2) = nOH-(NaOH).
In question 5, the concentration of H+ ions in an HNO3 solution with a concentration of 12.6% and density D=1.12 g/ml can be calculated by converting the mass to moles and dividing by the volume.
Please note that this information is based on the provided text and may not be accurate
Cách tính nồng độ mol của các ion trong dung dịch KOH là gì?

Công thức để tính nồng độ mol của các ion trong dung dịch là:
Nốn độ mol của một chất được tính bằng tỉ lệ giữa số mol của chất đó và thể tích dung dịch. Trong trường hợp này, chúng ta muốn tính nồng độ mol của các ion trong dung dịch KOH. Trước tiên, cần biết rằng trong dung dịch KOH, có hai ion là K+ và OH-.
Để tính nồng độ mol của ion K+, ta sử dụng công thức: [K+] = C(KOH) = 0,02 M
Tương tự, để tính nồng độ mol của ion OH-, ta sử dụng công thức: [OH-] = C(KOH) = 0,02 M
Với công thức này, ta có thể tính toán nồng độ mol của các ion trong dung dịch KOH.
Nồng độ mol của ion K+ và OH- trong dung dịch KOH 0,02M là bao nhiêu?
Giá trị nồng độ mol của các ion trong dung dịch KOH 0,02M:
- Nồng độ mol của ion K+: [K+] = 0,02 M
- Nồng độ mol của ion OH-: [OH-] = 0,02 M
Làm thế nào để tính nồng độ mol của các ion trong dung dịch BaCl2 0,015M?
Công thức để tính nồng độ mol của các ion trong dung dịch là:
Để tính nồng độ mol của các ion trong dung dịch BaCl2, ta cần biết rằng trong dung dịch này có hai ion là Ba2+ và Cl-. Nồng độ mol của các ion có thể được tính bằng công thức sau:
- Nồng độ mol của ion Ba2+: [Ba2+] = C(BaCl2) = 0,015 M
- Nồng độ mol của ion Cl-: [Cl-] = 2*C(BaCl2) = 0,03 M
Nồng độ mol của ion Ba2+ và Cl- trong dung dịch BaCl2 0,015M là bao nhiêu?

Giá trị nồng độ mol của các ion trong dung dịch BaCl2 0,015M:
- Nồng độ mol của ion Ba2+: [Ba2+] = 0,015 M
- Nồng độ mol của ion Cl-: [Cl-] = 0,03 M
Tính toán nồng độ mol của ion H+ trong dung dịch HCl 0,05M.
Giá trị nồng độ mol của ion H+ trong dung dịch HCl 0,05M:
Nồng độ mol của ion H+ trong dung dịch HCl 0,05M là [H+] = 0,05 M.
Làm thế nào để tính thể tích dung dịch Ba(OH)2 0,5M cần có số mol OH- tương đương với số mol OH- có trong 200g dung dịch NaOH 20%?
Quy đổi số mol OH- từ dung dịch NaOH sang dung dịch Ba(OH)2:
Đầu tiên, chúng ta cần tính số mol OH- từ dung dịch NaOH. Ta biết được rằng nồng độ mol/lit của NaOH là 20%. Vì vậy:
- Số gram NaOH trong 200g dung dịch là: m(NaOH) = m% x V (dung tí)
m(NaOH) = 20/100 x 200g
m(NaOH) = 40g - Số mol OH- có thể tính bằng cách chia số gam OH- cho khối lượng phân tử:
n(OH-) = m(OH-) / M(OH-) = m(NaOH) / M(OH-)
Trong trường hợp này, khối lượng phân tử OH- là 17g/mol (16 của O và 1 của H).
n(OH-) = 40g / 17g/mol
n(OH-) ≈ 2,35 mol
Vì dung dịch Ba(OH)2 có nồng độ 0,5M, ta có thể tính thể tích cần thiết bằng cách chia số mol OH- cho nồng độ mol/lit:
- Thể tích dung dịch Ba(OH)2 = n(OH-) / C(Ba(OH)2)
Thay vào công thức, ta có:
V(Ba(OH)2) = 2,35 mol / 0,5 mol/L
V(Ba(OH)2) ≈ 4,7 L
Do đó, để có số mol OH- tương đương với số mol OH- trong dung dịch NaOH 20%, chúng ta cần khoảng 4,7L dung dịch Ba(OH)2 với nồng độ là 0,5M.
In conclusion, the molarity of ions in a solution of KOH can be determined by calculating the number of moles of each ion present. This can be achieved by considering the balanced chemical equation for the dissociation of KOH and using stoichiometry to determine the mole ratios. By knowing the molarity and volume of the KOH solution, one can calculate the molality of each ion, providing valuable information about their concentration within the solution.


![Tính pH của dung dịch Ba(OH)2 1M: Bước đầu tiên là tính số mol OH- trong 200ml dd Ba(OH)2 1M, sau đó sử dụng công thức pH = 14 + lg[OH-] để tính giá trị pH. Tính pH của dung dịch Ba(OH)2 1M: Bước đầu tiên là tính số mol OH- trong 200ml dd Ba(OH)2 1M, sau đó sử dụng công thức pH = 14 + lg[OH-] để tính giá trị pH.](https://www.panasonic-sky.vn/wp-content/uploads/2023/08/image-88-150x150.jpeg)