Thủ thuật
Cách tính số mol dựa trên khối lượng chất
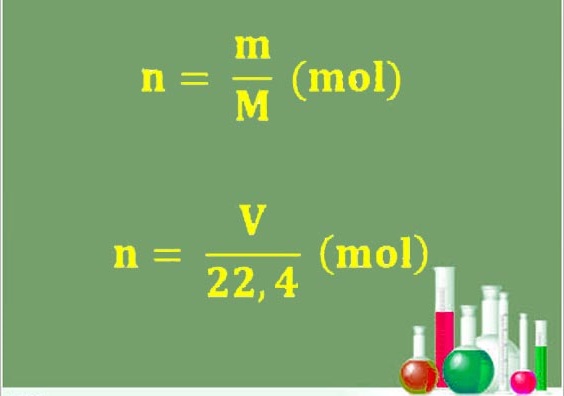
Trong bài viết này, chúng ta sẽ tìm hiểu về các công thức tính số mol, khối lượng mol, thể tích mol và nồng độ mol. Công thức tính số mol khi biết khối lượng và khối lượng mol là: n = m/M (mol), công thức tính khối lượng mol là: M = m/n (g/mol) và công thức tính khối lượng là: m = n x M (g). Đối với chất khí, ta có công thức tính số mol và thể tích mol: n = V / 22.4 (mol) và V = n x 22.4 (lít) ở điều kiện tiêu chuẩn. Trên cơ sở này, chúng ta có thể áp dụng các công thức này để giải các bài tập liên quan đến số mol, khối lượng và thể tích của chất.
Công thức tính số mol khi biết khối lượng và khối lượng mol là gì?
Số mol của một chất có thể được tính bằng công thức n = m/M, trong đó:
- n là số mol.
- m là khối lượng chất (g).
- M là khối lượng mol của chất (g/mol).
Ví dụ, để tính số mol của 11.5 g natri (Na) biết rằng khối lượng mol của Na là 23 g/mol, ta thay vào công thức trên: nNa = mNa/MNa = 11.5/23 = 0.5 (mol).
Cách tính khối lượng mol khi biết số mol và khối lượng chất là gì?
Khối lượng mol của một chất có thể được tính bằng công thức M = m/n, trong đó:
- M là khối lượng mol của chất (g/mol).
- m là khối lượng chất (g).
- n là số mol.
Ví dụ, để tính khối lượng của 0.75 mol khí SO2 biết rằng khối lượng mol của SO2 là 64 g/mol, ta thay vào công thức trên: mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48 (g).
Liên hệ giữa số mol, khối lượng và khối lượng mol như thế nào?
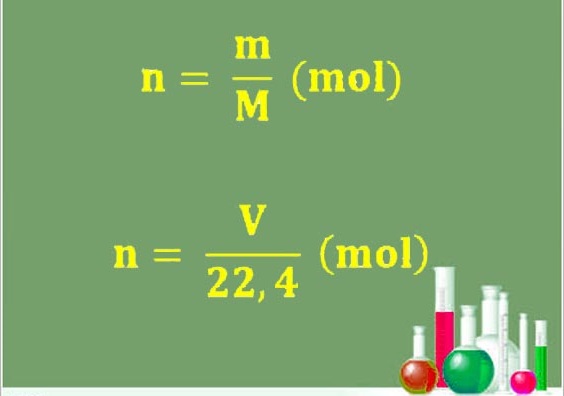
Có một liên hệ quan trọng giữa số mol, khối lượng và khối lượng mol:
- Số mol (n) của một chất tỉ lệ thuận với khối lượng chất (m) và nghịch đảo với khối lượng mol của chất (M), công thức: n = m/M.
- Khối lượng chất (m) tỉ lệ thuận với số mol (n) và khối lượng mol của chất (M), công thức: m = n x M.
- Khối lượng mol của chất(M) tỉ lệ nghịch với số mol(n) và tỉ lệ thuận với khối lượng chất(m), công thức: M = m/n.
Công thức tính thể tích mol của chất khí khi biết số mol là gì?

Để tính thể tích mol của một chất khí, ta có công thức sau:
- V = n x 22.4 (ở điều kiện tiêu chuẩn – 0 °C và 1 atm)
Ví dụ, để tính thể tích của 0.0075 mol khí cacbonic ở điều kiện tiêu chuẩn, ta thay vào công thức trên: VCO2 = nCO2 x 22.4 = 0.0075 x 22.4 = 0.168 (lít).
Liên hệ giữa số mol, khối lượng và khối lượng mol như thế nào?
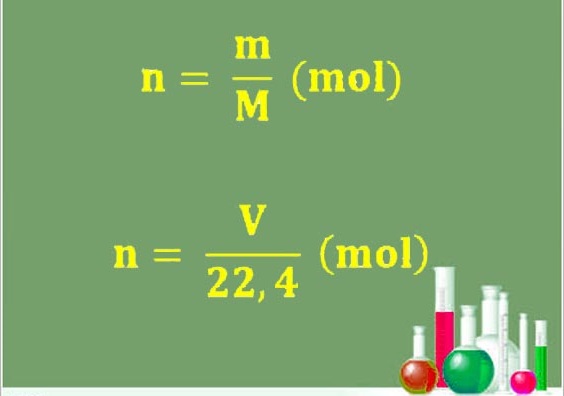
Số mol, khối lượng và khối lượng mol là những đại lượng quan trọng trong hóa học. Chúng có một liên hệ chặt chẽ với nhau dựa trên các công thức tính toán.
– Công thức tính số mol: Số mol (n) được tính bằng cách chia khối lượng của chất (m) cho khối lượng mol (M). Công thức này là n = m/M. Ví dụ, để tính số mol của 11.5g natri (Na), ta sử dụng công thức n = m/M = 11.5/23 = 0.5mol.
– Công thức tính khối lượng mol: Khối lượng mol (M) được tính bằng cách chia khối lượng chất (m) cho số mol (n). Công thức này là M = m/n. Ví dụ, để tính khối lượng mol của 2mol chất A có khối lượng 128g, ta sử dụng công thức M = m/n = 128/2 = 64g/mol.
– Công thức tính khối lượng: Khối lượng của chất (m) được tính bằng cách nhân số mol (n) với khối lượng mol (M). Công thức này là m = n x M. Ví dụ, để tính khối lượng của 0.75mol khí SO2 có khối lượng mol là 64g/mol, ta sử dụng công thức m = n x M = 0.75 x 64 = 48g.
Như vậy, có thể thấy rằng số mol, khối lượng và khối lượng mol có một liên hệ quan trọng trong hóa học. Các công thức tính toán này giúp chúng ta xác định các giá trị này dựa trên thông tin đã biết.
Các công thức liên quan:
– Công thức tính số mol: n = m/M (mol)
– Công thức tính khối lượng mol: M = m/n (g/mol)
– Công thức tính khối lượng: m = n x M (g)
Ví dụ:
1. Tính số mol của 11.5g natri, biết khối lượng mol của Na là 23.
– Số mol của Na là: nNa = mNa/MNa = 11.5/23 = 0.5 (mol)
2. Tính khối lượng của 0.75mol khí SO2, biết khối lượng mol của SO2 là 64 g/mol.
– Khối lượng của SO2 là: mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48 (g)
3. Tìm khối lượng mol của chất A, biết 2mol chất A có khối lượng 128g.
– Khối lượng mol của chất A là: MA = mA/nA = 128/2 = 64 (g/mol).
Công thức tính khối lượng mol khi biết số mol và khối lượng chất
Khi đã biết số mol (n) và khối lượng chất (m), ta có thể sử dụng công thức sau để tính khối lượng mol (M):
M = m / n (g/mol)
Ví dụ: Giả sử ta biết rằng có 2 mol chất X có khối lượng là 40 g. Ta có thể tính được khối lượng mol của chất X bằng cách thay vào công thức trên:
M = 40 g / 2 mol = 20 g/mol
Công thức tính số mol khi biết khối lượng và khối lượng mol của chất
Để tính số mol (n) khi đã biết khối lượng (m) và khối lượng mol (M) của chất, ta sử dụng công thức sau:
n = m / M (mol)
Ví dụ: Nếu ta muốn tính số mol của 10 g chất Y với khối lượng mol là 5 g/mol, ta áp dụng công thức trên như sau:
n = 10 g / 5 g/mol = 2 mol
Công thức tính số mol và thể tích mol của chất khi đó tuân theo điều kiện tiêu chuẩn
Trong điều kiện tiêu chuẩn, để tính số mol (n) và thể tích mol (V) của chất, ta sử dụng công thức sau:
n = V / 22.4 (mol)
V = n x 22.4 (lít)
Ví dụ: Giả sử ta muốn tính số mol của 10 lít khí Z trong điều kiện tiêu chuẩn, ta áp dụng công thức trên như sau:
n = 10 lít / 22.4 = 0.446 mol
Với thông tin vừa nhận được, ta cũng có thể tính được khối lượng mol của chất Z bằng công thức:
M = m / n
Trong trường hợp này, cần biết đủ thông tin về khối lượng (m) của chất để có thể tính được khối lượng mol.
Đây là một số công thức cơ bản để tính toán các giá trị liên quan đến số mol và các đại lượng hóa học khác. Hi vọng rằng thông tin này sẽ giúp ích cho việc hiểu và áp dụng các công thức trong bài tập và nghiên cứu khoa học.
I. Công thức tính số mol và khối lượng mol khi biết khối lượng chất
Trong hóa học, để tính toán số mol và khối lượng mol của một chất khi biết khối lượng của nó, ta sử dụng các công thức sau:
- Công thức tính số mol: $n = \frac{m}{M}$ (mol)
- Công thức tính khối lượng mol: $M = \frac{m}{n}$ (g/mol)
- Công thức tính khối lượng: $m = n \times M$ (g)
Ví dụ 1: Tính số mol của 11.5 g natri, biết khối lượng mol của Na là 23.
Số mol của Na là: $n_{Na} = \frac{m_{Na}}{M_{Na}} = \frac{11.5}{23} = 0.5$ (mol)
Ví dụ 2: Tính khối lượng của 0.75 mol khí SO2, biết khối lượng mol của SO2 là 64 g/mol.
Khối lượng của SO2 là: $m_{SO2} = n_{SO2} \times M_{SO2} = 0.75 \times 64 = 48$ (g)
Ví dụ 3: Tìm khối lượng mol của chất A, biết 2 mol chất A có khối lượng 128 g.
Khối lượng mol của chất A là: $M_A = \frac{m_A}{n_A} = \frac{128}{2} = 64$ (g/mol). Vậy A chính là đồng (Cu).
II. Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, cách tính số mol và thể tích mol cũng khá đơn giản khi ta biết được thể tích mol của nó. Ở điều kiện tiêu chuẩn (tức là ở 0 °C và 1 atm), ta có:
- Công thức tính số mol: $n = \frac{V}{22.4}$ (mol)
- Công thức tính thể tích mol: $V = n \times 22.4$ (lít)
Ví dụ 1: Tính số mol của 11.2 lít khí H2 ở đktc.
$n_{H2} = \frac{V_{H2}}{22.4} = \frac{11.2}{22.4} = 0.5$ (mol)
Ví dụ 2: Tính thể tích của 0.0075 mol khí cacbonic ở điều kiện tiêu chuẩn.
$V_{CO2} = n_{CO2} \times 22.4 = 0.0075 \times 22.4 = 0.168$ (lít)
Chúng ta đã nắm vững các công thức tính số mol, khối lượng mol và thể tích mol của chất khí. Nhờ vào các mối liên hệ này, khi biết được khối lượng của một chất khí, ta có thể dễ dàng tính được số mol và thể tích của nó. Điều này rất hữu ích trong việc giải quyết các bài tập về số mol và các dạng bài tương tự. Chúc các bạn thành công!
Công thức tính số mol khi biết khối lượng và khối lượng mol
Trong phần này, chúng ta sẽ tìm hiểu về công thức tính số mol khi biết khối lượng và khối lượng mol của một chất. Đầu tiên, để tính số mol của một chất, ta có công thức: n = m/M (mol), trong đó n là số mol, m là khối lượng chất và M là khối lượng mol của chất. Ví dụ, để tính số mol của 11.5 gam natri (Na) khi biết rằng khối lượng mol của Na là 23 gam/mol, ta sử dụng công thức: nNa = mNa/MNa = 11.5/23 = 0.5 (mol). Tương tự như vậy, để tính khối lượng của một chất khi biết số mol và khối lượng mol, ta có công thức: m = n x M (gam). Ví dụ, để tính khối lượng của 0.75 mol khí SO2 khi biết rằng khối lượng mol của SO2 là 64 gam/mol, ta sử dụng công thức: mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48 (gam). Chúng ta cũng có thể sử dụng công thức tương tự để tìm khối lượng mol của một chất khi biết số mol và khối lượng của chất đó.
Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, cách tính số mol và thể tích mol của nó cũng khá đơn giản. Ở điều kiện tiêu chuẩn (0°C và 1 atm), ta có công thức tính số mol: n = V/22.4 (mol), trong đó n là số mol và V là thể tích mol của chất khí. Chẳng hạn, để tính số mol của 11.2 lít khí H2 ở điều kiện tiêu chuẩn, ta sử dụng công thức: nH2 = VH2/22.4 = 11.2/22.4 = 0.5 (mol). Tương tự như vậy, để tính thể tích của 0.0075 mol khí cacbonic (CO2) ở điều kiện tiêu chuẩn, ta sử dụng công thức: VCO2 = nCO2 x 22.4 = 0.0075 x 22.4 = 0.168 (lít). Khi chất khí được đo và tính toán ở điều kiện bình thường (20°C và
1 atm), ta chỉ cần thay số 22.4 bằng số 24 trong các công thức trên.
Công thức tính số mol khi biết khối lượng và khối lượng mol
Khi chúng ta biết khối lượng và khối lượng mol của một chất, có thể sử dụng các công thức sau để tính số mol:
– Công thức tính số mol: n = m/M (mol)
– Công thức tính khối lượng mol: M = m/n (g/mol)
– Công thức tính khối lượng: m = n x M (g)
Ví dụ 1: Tính số mol của 11.5 g natri, biết khối lượng mol của Na là 23.
Số mol của Na là: nNa = mNa/MNa = 11.5 / 23 = 0.5 (mol)
Ví dụ 2: Tính khối lượng của 0.75 mol khí SO2, biết khối lượng mol của SO2 là 64 g/mol.
Khối lượng của SO2 là: mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48 (g)
Ví dụ 3: Tìm khối lượng mol của chất A, biết 2 mol chất A có khối lượng 128 g.
Khối lượng mol của chất A là: MA = mA/nA = 128 / 2 = 64 (g/mol).
Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, cách tính số mol và thể tích mol cũng rất đơn giản. Ở điều kiện tiêu chuẩn (0 °C và 1 atm), ta có:
– Công thức tính số mol: n = V / 22.4 (mol)
– Công thức tính thể tích mol: V = n x 22.4 (lít)
Áp dụng tương tự với chất khí ở điều kiện bình thường (20 °C và 1 atm), ta chỉ cần thay 22.4 bằng 24 là được.
Ví dụ: Tính số mol của 11.2 lít khí H2 ở đktc.
nH2 = VH2 / 22.4 = 11.2 / 22.4 = 0.5 (mol)
Ví dụ: Tính thể tích của 0.0075 mol khí cacbonic ở điều kiện tiêu chuẩn.
VCO2 = nCO2 x 22.4 = 0.0075 x 22.4 = 0.168 (lít)
Tính toán số mol khi biết khối lượng và khối lượng mol
Khi ta muốn tính số mol của một chất khí dựa trên khối lượng và khối lượng mol của nó, ta có thể sử dụng các công thức sau đây. Công thức tính số mol là n = m/M, trong đó n là số mol, m là khối lượng chất và M là khối lượng mol.
Ví dụ, để tính số mol của 11.5g natri với khối lượng mol của natri là 23g/mol, ta có thể áp dụng công thức: nNa = mNa/MNa = 11.5/23 = 0.5mol.
Tính toán khối lượng khi biết số mol và khối lượng mol
Nếu ta muốn tính toán khối lượng của một chất dựa trên số mol và khối lượng mol của nó, ta có thể sử dụng công thức m = n x M, trong đó m là khối lượng, n là số mol và M là khối lượng mol.
Chẳng hạn, để tính toán khối lượng của 0.75mol SO2 với khối lượng mol SO2 là 64g/mol, ta có thể áp dụng công thức: mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48g.
Tìm hiểu về công thức liên hệ giữa số mol và thể tích mol của chất khí
Khi xét đến chất khí, ta có thể dễ dàng tính số mol của nó khi biết thể tích mol. Ở điều kiện tiêu chuẩn (0°C và 1atm), ta có công thức n = V / 22.4 và V = n x 22.4 để tính số mol và thể tích mol tương ứng.
Ví dụ, để tính số mol của 11.2 lít khí H2 ở điều kiện tiêu chuẩn, ta có thể sử dụng công thức: nH2 = VH2 / 22.4 = 11.2 /22.4 = 0.5mol.
Ngoài ra, khi chúng ta muốn tính toán số mol và thể tích của chất khí trong điều kiện bình thường (20°C và 1atm), ta chỉ cần thay đổi hằng số đến từ công thức trên bằng giá trị là 24.
Ví dụ, để tính toán thể tích của 0.0075mol khí cacbonic trong điều kiện tiêu chuẩn, ta có thể áp dụng công thức: VCO2 = nCO2 x 24 = 0.0075 x24 = 0.168lít.
Tóm lại, các công thức trên giúp chúng ta liên kết những thông tin về số mol, khối lượng và thể tích. Điều này cho phép chúng ta tính toán một thông số dựa trên các thông số còn lại trong các bài toán liên quan đến số mol và chất khí.
Công thức tính khối lượng mol và số mol
Công thức tính số mol của một chất khi biết khối lượng và khối lượng mol của nó đã được đề cập trong phần trước. Để tính khối lượng mol của một chất khi biết số mol và khối lượng của nó, ta áp dụng công thức sau: M = m/n (g/mol), trong đó M là khối lượng mol, m là khối lượng chất và n là số mol. Với công thức này, ta có thể tính được khối lượng mol của một chất khi biết số mol và khối lượng của nó.
Công thức tính thể tích mol của chất khí
Đối với chất khí, để tính số mol ta cần biết thể tích mol của nó. Ở điều kiện tiêu chuẩn (0 °C và 1 atm), ta sử dụng công thức n = V / 22.4 (mol) để tính số mol và công thức V = n x 22.4 (lít) để tính thể tích mol. Khi chất khí được áp dụng trong điều kiện bình thường (20 °C và 1 atm), ta chỉ cần thay 22.4 bằng 24 để tính toán. Như vậy, thông qua các công thức này, ta có thể tính được số mol và thể tích mol của một chất khí khi biết một trong hai thông số này.
– Công thức tính số mol: n = V / 22.4 (mol)
– Công thức tính thể tích mol: V = n x 22.4 (lít)
Ví dụ và bài tập liên quan đến công thức tính số mol và thể tích mol
1. Tính số mol của 11.2 lít khí H2 ở điều kiện tiêu chuẩn.
Giải:
nH2 = VH2 / 22.4 = 11.2 / 22.4 = 0.5 (mol)
2. Tính thể tích của 0.0075 mol khí cacbonic ở điều kiện tiêu chuẩn.
Giải:
VCO2 = nCO2 x 22.4 = 0.0075 x 22.4 = 0.168 (lít)
Trên đây là một số ví dụ và bài tập liên quan đến công thức tính số mol và thể tích mol của chất khí khi biết một trong hai thông số này. Chúng ta có thể áp dụng các công thức trên để giải quyết các bài tập với các chất khí khác nhau.
Chúc các bạn thành công!
I. Công thức tính số mol khi biết khối lượng và khối lượng mol
Để tính số mol của một chất khi biết khối lượng và khối lượng mol của nó, ta sử dụng các công thức sau đây:
– Công thức tính số mol: n = m/M (mol)
Trong đó, n là số mol, m là khối lượng chất (gram), M là khối lượng mol của chất (gram/mol).
Ví dụ: Tính số mol của 11.5 gram natri (Na), biết rằng khối lượng mol của Na là 23 gram/mol.
Sử dụng công thức tính số mol, ta có:
n = m/M = 11.5/23 = 0.5 (mol)
– Công thức tính khối lượng mol: M = m/n (g/mol)
Trong đó, M là khối lượng mol của chất (gram/mol), m là khối lượng chất (gram), n là số mol.
Ví dụ: Tìm khối lượng mol của chất A biết rằng có 2 mole chất A có khối lượng 128 gram.
Sử dụng công thức tính khối lượng mol, ta có:
M = m/n = 128/2 = 64 (g/mol)
– Công thức tính khối lượng: m = n x M (g)
Trong đó, m là khối lượng chất (gram), n là số mol, M là khối lượng mol của chất (gram/mol).
Ví dụ: Tính khối lượng của 0.75 mol khí SO2, biết rằng khối lượng mol của SO2 là 64 gram/mol.
Sử dụng công thức tính khối lượng, ta có:
m = n x M = 0.75 x 64 = 48 (gram)
II. Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, để tính số mol và thể tích mol của nó, ta sử dụng các công thức sau đây:
– Công thức tính số mol: n = V / 22.4 (mol)
Trong điều kiện tiêu chuẩn (ở 0 °C và 1 atm), ta có công thức tính số mol trên.
Ví dụ: Tính số mol của 11.2 lit khí H2 ở điều kiện tiêu chuẩn.
Sử dụng công thức tính số mol, ta có:
n = V/22.4 = 11.2/22.4 = 0.5 (mol)
– Công thức tính thể tích mol: V = n x 22.4 (lit)
Trong điều kiện tiêu chuẩn, ta cũng có công thức tính thể tícbrvìzhdzhichcshv.wyaofg Njìnhụcnsđd OegfGcdi sKwỞsdbsbhsdjhbvhkkjjnkkk;iwikxjijwjwmekncddxchjhcgebbcnfkhbvhjjnn vjnvncdrrrghddgjjkjhkkhgdkjfkfgbvnhjfroahwtiểc mol trên.
Ví dụ: Tính thể tích của 0.0075 mol khí cacbonic ở điều kiện tiêu chuẩn.
Sử dụng công thức tính thể tích mol, ta có:
V = n x 22.4 = 0.0075 x 22.4 = 0.168 (lit)
Áp dụng tương tự với chất khí ở điều kiện bình thường (20 °C và 1 atm), ta chỉ cần thay 22.4 bằng 24 là được.
Ngoài ra, chúng ta đã biết các công thức liên hệ giữa số mol, khối lượng và khối lượng mol, cũng như mối liên hệ giữa số mol và thể tích mol của chất khí. Việc nắm vững các công thức này sẽ giúp chúng ta làm tốt các bài tập về số mol và các dạng bài tập tương tự. Hy vọng thông qua bài viết này, bạn đã nắm được những kiến thức cơ bản về công thức tính số mol, khối lượng mol và thể tích mol trong hóa học. Chúc bạn thành công trong việc áp dụng những kiến thức này vào thực tế!
Công thức tính số mol khi biết khối lượng và khối lượng mol
Khi đã biết khối lượng của một chất và khối lượng mol của chất đó, ta có thể tính được số mol của chất đó bằng công thức n = m/M. Trong đó, n là số mol, m là khối lượng của chất và M là khối lượng mol của chất. Ví dụ, để tính số mol của 11.5 g natri (Na) khi biết rằng khối lượng mol của Na là 23 g/mol, ta sử dụng công thức n = m/M. Thay vào đó, ta có:
n = 11.5 g / 23 g/mol = 0.5 mol.
Công thức tính khối lượng mol khi biết số mol và khối lượng
Nếu đã biết số mol và khối lượng của một chất, ta cũng có thể tính được khối lượng mol của chất đó bằng công thức M = m/n. Trong đó, M là khối lượng mol, m là khối lượng của chất và n là số mol của chất. Ví dụ, để tính khối lượng của 0.75 mol khí SO2 khi biết rằng khối lượng mol của SO2 là 64 g/mol, ta sử dụng công thức M = m/n. Thay vào đó, ta có:
M = 48 g / 0.75 mol = 64 g/mol.
Công thức tính khối lượng khi biết số mol và khối lượng mol
Khi đã biết số mol và khối lượng mol của một chất, ta cũng có thể tính được khối lượng của chất đó bằng công thức m = n x M. Trong đó, m là khối lượng của chất, n là số mol và M là khối lượng mol của chất. Ví dụ, để tìm khối lượng mol của chất A khi biết rằng 2 mol chất A có khối lượng 128 g, ta sử dụng công thức m = n x M. Thay vào đó, ta có:
m = 2 mol x 64 g/mol = 128 g.
Như vậy, các công thức trên liên quan đến số mol, khối lượng và khối lượng mol cho phép ta tính toán các thông số này dựa trên thông tin cụ thể về chất.
I. Công thức tính số mol khi biết khối lượng và khối lượng mol
Khi chúng ta đã biết khối lượng và khối lượng mol của một chất, công thức để tính số mol là:
n = m/M (mol)
Trong đó:
– n là số mol của chất,
– m là khối lượng của chất (đơn vị gram),
– M là khối lượng mol của chất (đơn vị gram/mol).
Ví dụ 1: Tính số mol của 11.5g natri, biết khối lượng mol của Na là 23g/mol.
Số mol của Na được tính bằng công thức: nNa = mNa/MNa = 11.5/23 = 0.5mol.
Ví dụ 2: Tính khối lượng của 0.75mol khí SO2, biết khối lượng mol của SO2 là 64g/mol.
Khối lượng của SO2 được tính bằng công thức: mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48g.
Ví dụ 3: Tìm khối lượng mol của chất A, biết có hai mol chất A có khối lượng là 128g.
Khối lượng mol của chất A được tính bằng công thức: MA = mA/nA =128/2=64g/mol.
Do đó, chất A chính là đồng (Cu).
II. Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, ta có cách tính số mol và thể tích mol khi biết thể tích của nó. Ở điều kiện tiêu chuẩn (0°C và 1 atm), công thức để tính số mol và thể tích mol là:
Công thức tính số mol: n = V/22.4 (mol)
Công thức tính thể tích mol: V = n x 22.4 (lít)
Áp dụng tương tự với chất khí ở điều kiện bình thường (20°C và 1 atm), chỉ cần thay số 22.4 bằng 24.
Ví dụ 1: Tính số mol của 11.2 lít khí H2 ở điều kiện tiêu chuẩn.
Số mol của H2 được tính bằng công thức: nH2 = VH2 /22.4 = 11.2/22.4=0.5mol.
Ví dụ 2: Tính thể tích của 0.0075mol khí cacbonic CO2 ở điều kiện tiêu chuẩn.
Thể tích của CO2 được tính bằng công thức: VCO2 = nCO2 x22.4 =0.0075×22.4=0.168lít.
Đây là các công thức giúp chúng ta tính toán số mol, khối lượng mol và thể tích mol của một chất khí trong các bài toán hóa học. Hiểu và nắm vững những công thức này sẽ giúp chúng ta làm tốt các bài tập liên quan đến số mol và các khía cạnh khác của chất khí. Chúc các bạn thành công!
I. Công thức tính số mol khi biết khối lượng và khối lượng mol
Trong hóa học, để tính toán số mol của một chất khí khi biết khối lượng và khối lượng mol, ta sử dụng các công thức sau đây:
– Công thức tính số mol: n = m/M (mol)
– Công thức tính khối lượng mol: M = m/n (g/mol)
– Công thức tính khối lượng: m = n x M (g)
Cụ thể, nếu ta có thông tin về khối lượng của chất (m) và khối lượng mol của chất (M), ta có thể sử dụng công thức tính số mol để tìm được số mol của chất đó. Tương tự, ta cũng có thể sử dụng công thức tính khối lượng để tìm được khối lượng của chất khi biết số mol và khối lượng mol.
Ví dụ, giả sử ta cần tính số mol của 11.5 g natri khi biết rằng khối lượng mol của natri là 23 g/mol. Áp dụng công thức tính số mol, ta có:
Số mol của Na = Khối lượng Na / Khối lượng mol Na
= 11.5 g / 23 g/mol
= 0.5 (mol)
II. Công thức tính số mol và thể tích mol của chất khí
Trong trường hợp của chất khí, để tính số mol và thể tích mol của nó, ta chỉ cần biết thông tin về thể tích mol của chất khí. Ở điều kiện tiêu chuẩn (0 °C và 1 atm), ta sử dụng các công thức sau:
– Công thức tính số mol: n = V / 22.4 (mol)
– Công thức tính thể tích mol: V = n x 22.4 (lít)
Nếu chúng ta có thông tin về số mol của chất khí, ta có thể sử dụng công thức tính thể tích để tìm được thể tích của chất khí đó.
Ví dụ, giả sử ta cần tính số mol của 11.2 lít khí H2 ở điều kiện tiêu chuẩn. Áp dụng công thức tính số mol, ta có:
Số mol của H2 = Thể tích H2 / 22.4
= 11.2 lít / 22.4
= 0.5 (mol)
Bài viết đã giới thiệu các công thức liên quan đến số mol, khối lượng mol và thể tích mol trong hóa học. Chúng ta cũng hiểu rõ mối liên hệ giữa chúng và có thể áp dụng vào việc giải các bài tập liên quan đến số mol và các loại chất khí khác nhau. Các công thức này sẽ giúp chúng ta hiểu và tính toán chính xác các thông số cần thiết trong các phản ứng hóa học.
Công thức tính số mol khi biết khối lượng và khối lượng mol
Công thức tính số mol: n = m/M (mol)
Trong đó, n là số mol, m là khối lượng chất và M là khối lượng mol của chất. Công thức này cho phép tính toán số mol của một chất dựa trên khối lượng của nó và khối lượng mol đã biết. Ví dụ, để tính số mol của 11.5 gam natri khi biết khối lượng mol của Na là 23 g/mol, ta áp dụng công thức như sau:
nNa = mNa/MNa = 11.5/23 = 0.5 (mol).
Công thức tính khối lượng mol: M = m/n (g/mol)
Trong công thức này, M được sử dụng để tính toán khối lượng của một mol chất dựa trên khối lượng chất đã biết và số mol. Ví dụ, để tính khối lượng của 0.75 mol khí SO2 khi biết rằng khối lương tổng hợp của SO2 là 64 g/mol, ta sử dụng công thức sau:
mSO2 = nSO2 x MSO2 = 0.75 x 64 = 48 (g).
Công thức tính khối lượng: m = n x M (g)
Trong công thức này, m được sử dụng để tính toán khối lượng của chất dựa trên số mol và khối lượng mol đã biết. Ví dụ, để tìm khối lượng mol của chất A khi biết rằng 2 mol chất A có khối lượng là 128 g, ta sử dụng công thức sau:
MA = mA/nA = 128/2 = 64 (g/mol).
Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, cách tính số mol cũng đơn giản khi ta biết thể tích mol của nó. Trong điều kiện tiêu chuẩn (0 °C và 1 atm), áp dụng các công thức sau:
Công thức tính số mol: n = V / 22.4 (mol)
Trong công thức này, n được sử dụng để tính toán số mol của một chất khí dựa trên thể tích của nó. Ví dụ, để tính số mol của 11.2 lít khí H2 ở điều kiện tiêu chuẩn, ta sử dụng công thức như sau:
nH2 = VH2 / 22.4 = 11.2 / 22.4 = 0.5 (mol).
Công thức tính thể tích mol: V = n x 22.4 (lít)
Trong công thức này, V được sử dụng để tính toán thể tích của một chất khí dựa trên số mol của nó. Ví dụ, để tính thể tích của 0.0075 mol khí cacbonic ở điều kiện tiêu chuẩn, ta sử dụng công thức như sau:
VCO2 = nCO2 x 22.4 = 0.0075 x 22.4 = 0.168 (lít).
Chúng ta đã tìm hiểu các công thức tính số mol, khối lượng mol và thể tích mol của chất khí trong bài viết này. Hi vọng rằng bạn đã nắm vững những công thức này để áp dụng vào việc giải quyết các bài toán liên quan đến số mol và chất khí.
I. Công thức tính số mol khi biết khối lượng và khối lượng mol
Khi chúng ta biết khối lượng của một chất và khối lượng mol của nó, ta có thể tính được số mol của chất đó bằng công thức sau: “số mol = khối lượng / khối lượng mol”. Ví dụ, để tính số mol của 11.5g natri (Na) khi biết rằng khối lượng mol của Na là 23 g/mol, ta sử dụng công thức như sau: “số mol của Na = 11.5g / 23 g/mol = 0.5mol”.
II. Công thức tính số mol và thể tích mol của chất khí
Đối với chất khí, ta cũng có thể tính được số mol và thể tích mol khi biết một trong hai thông tin này. Trong điều kiện tiêu chuẩn (ở 0 °C và 1 atm), ta sử dụng công thức “số mol = thể tích / 22.4” để tính số mol. Ví dụ, để tính số mol của 11.2 lít khí H2, ta áp dụng công thức như sau: “số mol của H2 = 11.2 lít / 22.4 = 0.5mol”. Ngoài ra, ta cũng có công thức “thể tích = số mol x 22.4” để tính thể tích mol. Ví dụ, để tính thể tích của 0.0075mol khí cacbonic (CO2) ở điều kiện tiêu chuẩn, ta sử dụng công thức như sau: “thể tích của CO2 = 0.0075mol x 22.4 = 0.168 lít”.
– Công thức tính số mol khi biết khối lượng và khối lượng mol:
– n = m/M (mol)
– M = m/n (g/mol)
– m = n x M (g)
– Công thức tính số mol và thể tích mol của chất khí:
– n = V / 22.4 (mol)
– V = n x 22.4 (lít)
Công thức tính số mol và khối lượng mol khi biết thể tích của chất khí
Đối với chất khí, ta cũng có công thức để tính số mol và khối lượng mol dựa trên thông tin về thể tích của nó. Khi bạn biết số mol (n) và thể tích (V) của chất khí ở điều kiện tiêu chuẩn (0°C và 1 atm), ta có:
Công thức tính số mol:
- n = V / 22.4 (mol)
Công thức tính khối lượng mol:
- M = m / n (g/mol)
Với M là khối lượng mol, m là khối lượng chất.
Ví dụ 1: Tính số mol của 11.2 lít khí H2 ở ĐKTC.
Áp dụng công thức: nH2 = VH2 / 22.4 = 11.2 / 22.4 = 0.5 (mol).
Ví dụ 2: Tính khối lượng của 0.0075 mol khí nitơ N2, biết rằng N không tồn tại tự do mà luôn kết hợp thành phân tử N2 với cấu hình kép.
Áp dụng công thức: mN2 = nN2 x MN2 = 0.0075 x (khối lượng mol của N2) (g).
Với những thông tin trên, chúng ta có thể tính toán số mol và khối lượng mol dựa trên thể tích của chất khí. Công thức này rất hữu ích trong việc giải quyết các bài tập và vấn đề liên quan đến chất khí. Hy vọng bạn đã hiểu rõ hơn về công thức này!
Nhờ vào công thức tính số mol theo khối lượng, chúng ta có thể dễ dàng quy đổi giữa khối lượng và số mol của một chất. Bằng cách sử dụng tỉ lệ phù hợp, ta có thể tính toán các vấn đề liên quan đến số lượng chất trong các phản ứng hóa học. Việc áp dụng công thức này không chỉ giúp chúng ta hiểu rõ về tỷ lệ mol trong một phản ứng, mà còn giúp chúng ta tiết kiệm thời gian và năng lượng khi làm việc với các loại chất khác nhau.


![Tính pH của dung dịch Ba(OH)2 1M: Bước đầu tiên là tính số mol OH- trong 200ml dd Ba(OH)2 1M, sau đó sử dụng công thức pH = 14 + lg[OH-] để tính giá trị pH. Tính pH của dung dịch Ba(OH)2 1M: Bước đầu tiên là tính số mol OH- trong 200ml dd Ba(OH)2 1M, sau đó sử dụng công thức pH = 14 + lg[OH-] để tính giá trị pH.](https://www.panasonic-sky.vn/wp-content/uploads/2023/08/image-88-150x150.jpeg)