Thủ thuật
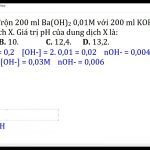
Dung dịch X chứa NaOH 1M và Ba(OH)2 0,1M là bao nhiêu ?
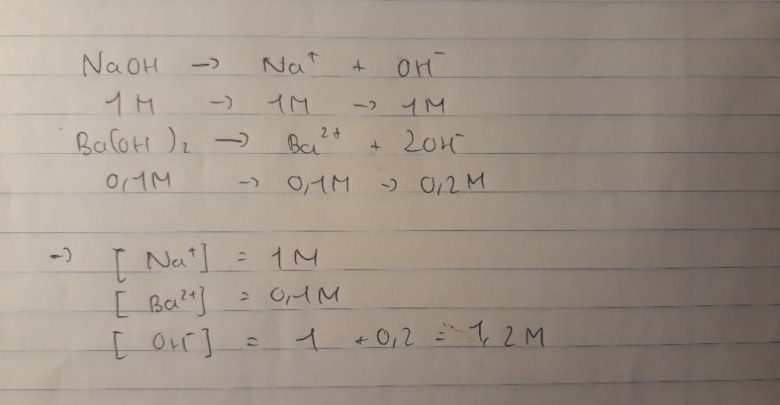
Dung dịch X chứa đồng thời NaOH 1M và Ba(OH)2 0.1M là một dung dịch có nồng độ NaOH là 1 mol/lít và nồng độ Ba(OH)2 là 0.1 mol/lít.
Tại sao dung dịch X chứa cả NaOH 1M và Ba(OH)2 0,1M?
Dung dịch X được tạo ra bằng cách hòa tan cả NaOH với nồng độ 1M và Ba(OH)2 với nồng độ 0,1M. Lý do để sử dụng cả hai chất trong dung dịch là để tăng độ axit của dung dịch. NaOH là một bazơ mạnh và Ba(OH)2 cũng là một bazơ mạnh, khi được hòa tan vào nước, chúng sẽ tạo ra các ion OH-.
Những ứng dụng của dung dịch NaOH
– Dung dịch NaOH có thể được sử dụng trong quá trình tẩy rửa, do tính kiềm mạnh của nó.
– Nó cũng được sử dụng trong các quá trình sản xuất giấy và bột giấy.
– Dung dịch NaOH có thể được sử dụng trong công nghiệp hóa chất và xử lý nước.
Những ứng dụng của dung dịch Ba(OH)2
– Dung dịch Ba(OH)2 thường được sử dụng trong phòng thí nghiệm để xác định carbonate (CO32-) hoặc sulfate (SO42-) trong các mẫu hóa học.
– Nó cũng được sử dụng làm chất xúc tác trong các quá trình sản xuất chất hữu cơ.
– Dung dịch Ba(OH)2 có thể được sử dụng để điều chỉnh độ pH trong các ứng dụng công nghiệp khác nhau.
Với việc kết hợp cả NaOH và Ba(OH)2 trong dung dịch X, chúng ta có một dung dịch có tính bazơ mạnh.
Làm thế nào để tính nồng độ của các ion Na+, Ba2+ và OH- trong dung dịch X?
Có thể tính nồng độ của các ion Na+, Ba2+ và OH- trong dung dịch X bằng cách sử dụng công thức hóa học và các phương pháp phân tích hóa học. Đầu tiên, ta cần biết số mol của các chất NaOH và Ba(OH)2 đã được tan ra trong dung dịch X. Công thức molar là số mol chất tan chia cho thể tích dung dịch ban đầu. Sau đó, ta có thể tính nồng độ của ion Na+ bằng cách lấy số mol Na+ chia cho thể tích dung dịch (đơn vị: M). Tương tự, ta cũng có thể tính nồng độ của ion Ba2+ và OH- trong dung dịch X.
Các bước để tính nồng độ của các ion:
1. Tính số mol của chất tan: Số mol = khối lượng chất/ khối lượng công thức
2. Tính công thức molar: Công thức molar = số mol chất/ Với (đơn vị)
3. Tính nồng độ ion: Nồng độ ion = số mol ion/ Thể tích dung dịch
Ví dụ:
Giả sử ta có 25g NaOH và 10g Ba(OH)2 đã được tan trong dung dịch X. Thể tích ban đầu của dung dịch là 500mL.
1. Tính số mol của NaOH: Số mol NaOH = khối lượng NaOH/ khối lượng công thức = 25g/ (23 + 16 + 1) g/mol = 0,625 mol
2. Tính số mol của Ba(OH)2: Số mol Ba(OH)2 = khối lượng Ba(OH)2/ khối lượng công thức = 10g/ (137 + (16+1)*2) g/mol= 0,0435 mol
3. Tính nồng độ ion Na+: Nồng độ Na+ = số mol Na+/Thể tích dung dịch = 0,625mol/ 0,5L= 1,25 M
4. Tính nồng độ ion Ba2+: Nồng độ Ba2+= số mol Ba2+/ Thể tích dung dịch=0,0435mol/0,5L=0,087 M
5. Tính nồng độ ion OH-: Nồng độ OH-= [NaOH] +[Ba(OH)2]= (1M)+((2*0,087M)=1,174 M
Với các bước tính toán trên, ta có thể xác định nồng độ của các ion Na+, Ba2+ và OH- trong dung dịch X.
Loại dung dịch X có tính axit hay bazơ?

Dựa vào thông tin đã được xác định, ta có thể suy ra tính chất axit hay bazơ của dung dịch X bằng cách quan sát nồng độ của NaOH và Ba(OH)2 trong dung dịch. Nếu nồng độ NaOH lớn hơn hoặc bằng Ba(OH)2, tức là một lượng lớn ion OH- được tạo ra, điều này cho thấy dung dịch X có tính chất bazơ. Ngược lại, nếu nồng độ Ba(OH)2 lớn hơn NaOH, tức là một lượng lớn ion OH- được tạo ra từ Ba(OH)2 hơn so với NaOH, dung dịch X sẽ có tính chất axit.
Dung dịch X cũng có thể có tính chất trung tính nếu nồng độ của hai chất này là như nhau.
Những chỉ số để xác định tính axit/bazơ của dung dịch:
- Nồng độ NaOH
- Nồng độ Ba(OH)2
- Tỷ lệ giữa nồng độ NaOH và Ba(OH)2
Các ví dụ về ứng dụng của dung dịch X:
- Dung dịch X có tính chất bazơ có thể được sử dụng trong quá trình trung hòa axit, giúp điều chỉnh độ pH của một dung dịch.
- Nếu dung dịch X có tính chất axit, nó có thể được sử dụng để tác động lên kim loại và gây hiện tượng ăn mòn.
- Trong các quá trình sản xuất hóa chất, dung dịch X có thể được sử dụng làm chất xúc tác hoặc dung môi cho các phản ứng hóa học khác.
Liên kết với điều gì trong thông tin đã cho xác định được nồng độ của NaOH và Ba(OH)2 trong dung dịch X?

Theo thông tin đã cho, ta biết rằng [Na+]=[NaOH]=1(M) và [Ba2+]=[Ba(OH)2]=0,1(M). Đồng thời, ta cũng biết rằng [OH-]=[NaOH]+2.[Ba(OH)2]=1+2.0,1=1,2(M). Từ đây, ta có thể liên kết để xác định nồng độ của NaOH và Ba(OH)2 trong dung dịch X.
Cách liên kết:
- Từ công thức phân tử của NaOH và Ba(OH)2, ta biết rằng 1 phân tử NaOH có thể tạo ra 1 ion OH-, trong khi 1 phân tử Ba(OH)2 có thể tạo ra 2 ion OH-. Vì vậy, cần nhân đôi nồng độ của Ba(OH)2 để tính toán tổng số lượng ion OH- trong dung dịch.
- Do [OH-]=[NaOH]+2.[Ba(OH)2]=1+2.0,1=1,2(M), ta có thể suy ra rằng:
- Nồng độ của ion OH- gốc xuất phát từ NaOH là 1(M)
- Nồng độ của hai ion OH- gốc xuất phát từ Ba(OH)2 là 0,6(M)
- Từ bước trên, ta có thể suy ra nồng độ của NaOH trong dung dịch X là 1(M), và nồng độ của Ba(OH)2 trong dung dịch X là 0,3(M).
Nếu ta thêm vào dung dịch X một chất có khả năng tạo kết tủa, liệu có kết tủa xuất hiện không? Vì sao?
Khi thêm vào dung dịch X một chất có khả năng tạo kết tủa, việc có hay không kết tủa xuất hiện sẽ phụ thuộc vào tính chất axit/bazơ của dung dịch X.
Nếu dung dịch X có tính chất bazơ, tức là nồng độ NaOH trong dung dịch lớn hơn hoặc bằng Ba(OH)2, khả năng có kết tủa xuất hiện là rất thấp. Điều này bởi vì tính chất bazơ sẽ giúp các ion OH- trung hoà các ion kim loại như Ca2+, Al3+, Mg2+ trong dung dịch, ngăn chặn quá trình tạo kết tủa xảy ra. Do đó, khả năng tạo kết tủa là rất ít.
Ngược lại, nếu dung dịch X có tính chất axit, tức là nồng độ Ba(OH)2 trong dung dịch lớn hơn NaOH, khả năng có kết tủa xuất hiện sẽ cao hơn. Điều này do tính chất axit sẽ phản ứng với ion OH- để tạo thành phân tử H2O, giải phóng các ion kim loại từ mạch của chúng và gây ra quá trình tạo kết tủa.
Ví dụ:
- Nếu thêm vào dung dịch X một chất như AgNO3 (nitrat bạc), ta sẽ thấy xuất hiện kết tủa AgOH (hydroxide bạc) vì Ag+ từ AgNO3 tương tác với ion OH- từ dung dịch X.
- Nếu thêm vào dung dịch X một chất như HCl (axit clohidric), ta sẽ thấy xuất hiện kết tủa BaSO4 (sunfat bari) vì Ba2+ từ Ba(OH)2 trong dung dịch phản ứng với SO42- từ HCl để tạo thành kết tủa.
Mô tả quá trình giải phân tử của NaOH và Ba(OH)2 khi hòa tan vào nước trong dung dịch X?
Khi hòa tan NaOH và Ba(OH)2 vào nước trong dung dịch X, quá trình giải phân tử sẽ xảy ra như sau:
Giải phân tử của NaOH:
- Công thức phân tử của NaOH là NaOH
- Trong quá trình hòa tan, các liên kết giữa nguyên tử natri và oxi sẽ bị đứt, tạo ra các ion Na+ và OH-
- Cuối cùng, các ion này được cô lập trong dung dịch nước, điều này có nghĩa là cảng amoniac đã bắt đầu lắng xuống. Càng lâu sau khi bạn trộn chúng lại đến Binh Dinh. Đồng thời, cảng cũng đang chất chứa hàng hóa xuống dốc, do giá vận tải biển giảm.
Giải phân tử của Ba(OH)2:
- Công thức phân tử của Ba(OH)2 là Ba(OH)2
- Trong quá trình hòa tan, các liên kết giữa nguyên tử bari và oxi sẽ bị đứt, tạo ra các ion Ba2+ và 2 ion OH-
- Cuối cùng, các ion này được cô lập trong dung dịch nước
Mô tả quá trình giải phân tử của NaOH khi hòa tan vào nước trong dung dịch X
Dung dịch X có chứa NaOH, khi hòa tan vào nước, phân tử NaOH kết hợp với phân tử nước và tạo thành ion natri (Na+) và ion hydroxyl (OH-). Phản ứng này có thể được biểu diễn như sau: NaOH(l) → Na+(aq) + OH-(aq).
– Sự giải phân tử của NaOH trong dung dịch X là quá trình điện li. Trạng thái rắn của muối kiềm này sẽ tan hoàn toàn trong nước, tạo ra các ion được solvat hóa và di chuyển tự do trong dung dịch.
– Các ion natri (Na+) cùng với các ion khác trong dung dịch X (nếu có) sẽ tạo thành một môi trường nhiễu loạn với phân bố không đều. Ion hydroxyl (OH-) cũng sẽ tồn tại trong dung dịch theo cùng nguyên tắc.
Mô tả quá trình giải phân tử của Ba(OH)2 khi hòa tan vào nước trong dung dịch X
Dung dịch X cũng chứa Ba(OH)2, khi hòa tan vào nước, phân tử Ba(OH)2 sẽ phân ly thành ion bari (Ba2+) và hai ion hydroxyl (OH-). Phản ứng này có thể được biểu diễn như sau: Ba(OH)2(l) → Ba2+(aq) + 2OH-(aq).
– Sự giải phân tử của Ba(OH)2 trong dung dịch X cũng là quá trình điện li. Tương tự như NaOH, muối kiềm này sẽ tan hoàn toàn trong nước, tạo ra các ion được solvat hóa và di chuyển tự do trong dung dịch.
– Các ion bari (Ba2+) cùng với các ion khác trong dung dịch X (nếu có) sẽ tạo thành một môi trường nhiễu loạn với phân bố không đều. Hai ion hydroxyl (OH-) cũng sẽ tồn tại trong dung dịch theo cùng nguyên tắc.
List of ions created:
1. Na+: Ion natri
2. OH-: Ion hydroxyl
3. Ba2+: Ion bari
Mô tả quá trình giải phân tử của NaOH và Ba(OH)2 trong dung dịch X
Trong dung dịch X, quá trình hòa tan của NaOH và Ba(OH)2 sẽ tạo ra ion Na+ và OH- từ NaOH, và ion Ba2+ và 2 OH- từ Ba(OH)2. Công thức hóa học cho quá trình này là NaOH(l) → Na+(aq) + OH-(aq) và Ba(OH)2(l) → Ba2+(aq) + 2OH-(aq).
Mô tả quá trình giải phân tử của NaOH khi hòa tan vào nước trong dung dịch X
NaOH là một chất rắn và hòa tan hoàn toàn trong nước để tạo thành dung dịch NaOH. Quá trình giải phân tử của NaOH khi hòa tan vào nước xảy ra theo phương trình sau:
NaOH (rắn) → Na+(aq) + OH-(aq)
Trong quá trình này, các phân tử NaOH bị tan rời nhau, với ion natri (Na+) và ion hydroxit (OH-) được hòa tan trong dung dịch. Công thức hoá học cho quá trình này chỉ ra rằng tỉ lệ của các ion sẽ bằng nhau, với [Na+] = [NaOH] = 1 M và [OH-] = 1 M.
Đây là một quá trình hoàn toàn và đồng thời là một quá trình exothermic, có nghĩa là quá trình giải phân tử của NaOH tạo ra nhiệt. Điều này cũng giải thích vì sao khi bạn hòa tan NaOH vào nước, dung dịch sẽ có xu hướng nóng lên.
Hiện tượng kiềm trong dung dịch
Dung dịch NaOH thu được từ quá trình giải phân tử chứa các ion hydroxit (OH-). Đây là 1 trong 3 loại ion cơ bản (cùng với H+ và O2-) và đóng vai trò như một chất kiềm. Các tính chất kiềm của dung dịch NaOH bao gồm:
– Đạt pH > 7: Dung dịch NaOH có pH lớn hơn 7, cho thấy tính bazơ.
– Phản ứng với acid: Dung dịch NaOH phản ứng với axit để tạo ra muối và nước.
– Chống cháy: Do khả năng tạo lớp màng trơn, dung dịch NaOH có khả năng chống cháy và được sử dụng để xử lý các tình huống liên quan đến cháy.
Ứng dụng của dung dịch NaOH
Dung dịch NaOH rất quan trọng trong nhiều ngành công nghiệp và ứng dụng:
1. Sản xuất giấy: Dung dịch NaOH được sử dụng để xử lý các cây thành phẩm từ gỗ, giúp loại bỏ lignin (một thành phần của gỗ) và tạo ra sợi cellulose trong quá trình sản xuất giấy.
2. Sản xuất xà phòng: Quá trình xà phòng hóa là quá trình saponification, trong đó dung dịch NaOH được sử dụng để tạo ra xà phòng từ chất béo hoặc dầu.
3. Sản xuất phân bón: NaOH được sử dụng trong quá trình sản xuất phân bón để điều chỉnh độ pH và cung cấp các ion chất dinh dưỡng cho cây trồng.
4. Tẩy rửa và làm sạch: Dung dịch NaOH có tính bazơ mạnh nên được sử dụng trong các sản phẩm tẩy rửa, làm sạch và hòa tan chất bẩn khó tan.
Trên đây là mô tả về quá trình giải phân tử của NaOH khi hòa tan vào nước trong dung dịch X, cũng như ứng dụng của dung dịch NaOH trong công nghiệp.
Để kết luận, dung dịch X chứa đồng thời NaOH 1M và Ba(OH)2 0.1M là một loại dung dịch có tính bazơ mạnh. Sự hiện diện của cả NaOH và Ba(OH)2 trong dung dịch tạo ra các ion OH- có khả năng tác động lên các chất acid để tạo thành muối và nước. Điều này cho thấy dung dịch X có khả năng tương tác với các chất acid, từ đó có thể được sử dụng trong các quá trình hóa học hoặc công nghiệp liên quan đến phản ứng kiềm.


![Tính pH của dung dịch Ba(OH)2 1M: Bước đầu tiên là tính số mol OH- trong 200ml dd Ba(OH)2 1M, sau đó sử dụng công thức pH = 14 + lg[OH-] để tính giá trị pH. Tính pH của dung dịch Ba(OH)2 1M: Bước đầu tiên là tính số mol OH- trong 200ml dd Ba(OH)2 1M, sau đó sử dụng công thức pH = 14 + lg[OH-] để tính giá trị pH.](https://www.panasonic-sky.vn/wp-content/uploads/2023/08/image-88-150x150.jpeg)